2023年12月5日,西湖大学党波波团队在Nature Communications杂志在线发表题为“Copper assisted sequence-specific chemical protein conjugation at a single backbone amide” 的研究论文。此研究开发了一种基于主链酰胺键单一位点选择性的蛋白质化学偶联方法,用于蛋白质特定位点标记,抗体偶联药物制备。
文章截图:

文章链接:
https://doi.org/10.1038/s41467-023-43753-7
蛋白质由不同氨基酸通过主链酰胺键串联形成。一个含有n个氨基酸的蛋白质有n-1个主链酰胺键。这些主链酰胺键极其相似,化学反应活性相比很多氨基酸侧链也低很多。那是否有可能完全通过化学手段实现蛋白质主链酰胺键选择性的化学修饰?在此之上,是否有可能通过化学手段在生物相容性的条件下实现复杂蛋白质上单一主链酰胺键的化学选择性修饰?这显然是一个非常大的挑战。而这种全新的蛋白质单一位点选择性化学修饰方法对于蛋白质性质、功能的基础研究、蛋白质-小分子偶联药物的转化研究都具有非常重要的意义。
目前,蛋白质单一位点选择性的修饰大都依赖于基因密码子拓展技术、或生物偶联酶,然而由于技术路线相对复杂,这些方法应用范围受到一定限制。
与此相比,蛋白质的直接化学偶联方法操作简便、成本低廉,在很多应用场景上更受青睐。然而,目前绝大多数化学偶联方法仅具备化学选择性,往往缺乏对单一位点的选择性。
为了突破这一瓶颈,党波波团队提出了一种创新的策略:通过金属离子特异性识别一段完全由天然氨基酸组成的多肽序列,来实现单一位点特异性的蛋白质化学偶联(图1)。基于此策略,党波波团队成功开发出一种单一主链酰胺键选择性的CAST(多肽序列-FFKKDDHAA-的)蛋白质化学偶联技术。反应动力学的研究显示,CAST偶联速率常数为8.1 M−1 s−1,t1/2不到2分钟。
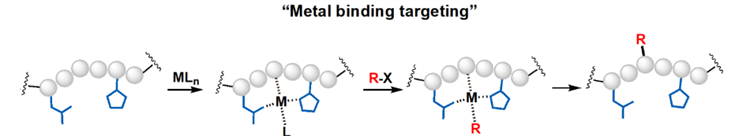
图1. “金属结合靶向”策略示意图。M为过渡金属离子,L为金属配体,R-X为活性小分子
基于CAST技术,党波波团队成功地在多种蛋白质上均可实现高效、位点可控的蛋白质单一位点选择性化学修饰。此定点化学修饰反应在完全生物相容条件下(水溶液,中性pH,低微摩尔蛋白浓度),在2小时内可以实现定量转化(图2)。
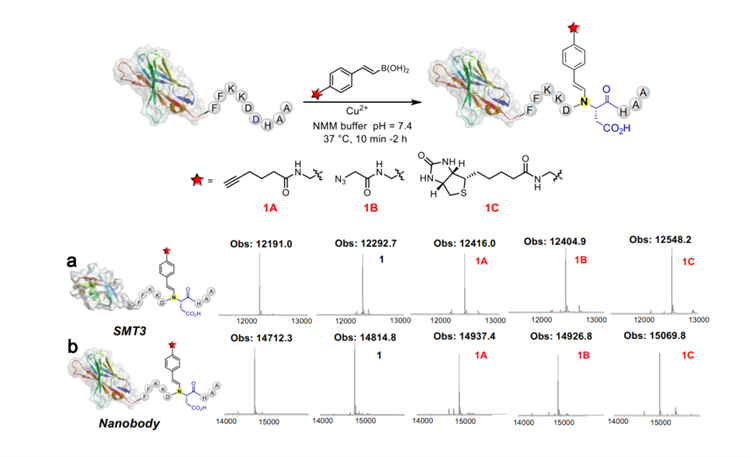
图2. C端融合CAST的蛋白质与各类功能性硼酸小分子的反应
抗体偶联药物(ADC)是一类近年来非常受关注的靶向药物,通过结合单抗的细胞选择性和小分子毒素的细胞毒性,选择性地杀伤恶性细胞。而制备ADC药物的关键技术就是抗体药物上的定点化学偶联技术。党波波团队随后将改进的、具有超高血浆稳定性的CASTi(-IAPDDHAA-)用于制备新的ADC药物Tra-CASTi-MMAE,此药物在产物均一性、稳定性方面都胜过目前临床上、或临床研究中所使用的大多数ADC药物。基于CASTi制备的Tra-CASTi-MMAE在HER2阳性人卵巢癌SK-OV-3(HER2+++)和人乳腺导管腺癌JIMT-1(HER2++)异种移植小鼠模型中具有显著的抗肿瘤功效(图3)。
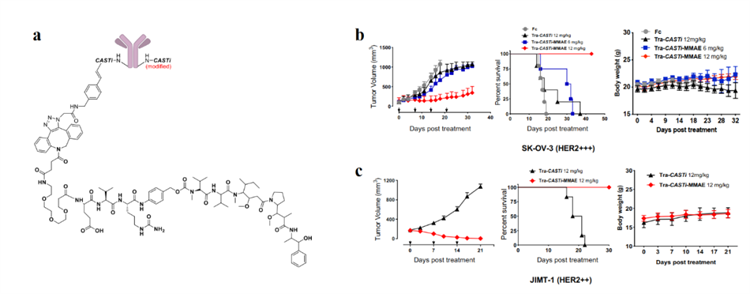
图3. a. Tra-CASTi-MMAE结构;b-c. Tra-CASTi-MMAE的体内抗肿瘤效果
总的来说,在此工作中,党波波团队提出了一种全新的蛋白质单一位点选择性化学修饰策略。基于此策略,党波波团队开发出了第一个单一主链酰胺键选择性的蛋白质化学修饰方法CAST,并将CAST用于多种蛋白质单一位点选择性标记,也用CAST制备了全新的均一、稳定、高体内活性的抗体偶联药物。因为CAST技术超高的效率以及选择性,未来CAST技术在蛋白质药物偶联物开发中将很有可能代替目前常用的化学方法或生物酶法,有很大的应用前景。
西湖大学2019级博士研究生郭梦准、郭樑,2021级博士研究生赵恺,浙江大学第二附属医院周瑞为研究共同第一作者,西湖大学党波波研究员、周挺研究员,雷英杰助理研究员为通讯作者。浙江大学杨兵教授,西湖大学黄晶研究员、章永登研究员提供了大力支持与帮助。本研究受到国家自然科学基金,西湖大学及西湖实验室的资助和支持。
西湖大学党波波团队围绕蛋白质工程,综合运用蛋白质化学合成,蛋白质设计,高通量蛋白质筛选等方法一方面开发蛋白质研究的新型技术手段,另一方面针对靶点蛋白,开发多肽、蛋白类大分子药物。
团队目前正积极招聘细胞生物学、化学生物学、有机化学、分子生物学等方向的研究人员。







