器官移植开展至今,移植器官的保存、手术及术后处理已日益成熟,受者存活率有所增高,但移植排斥反应仍然是威胁受者长期存活的重要因素。因此深入研究器官移植免疫排斥发生的细胞信号新机制,鉴定新的治疗靶点,对开发新型免疫制剂具有重大的理论及临床意义。中山大学药学院(深圳)邓文斌教授、陈红波和程芳副教授团队近三年在此研究领域取得了一系列重要成果。
首先,团队首次提出T细胞活化的核仁协同激活新理论,发现一个核仁定位蛋白复合体NF45/90通过调控核仁rDNA基因转录和核糖体组装,是T细胞活化经典信号通路“calcineurin-NFAT-IL-2”不可或缺的协同刺激信号;并成功将一个抗癌“老药”CX5461的适应症扩展到器官移植免疫排斥研究领域(EMBO Mol Med, 2021 Mar 5;13(3):e12834. IF=12.1)。
此外,该研究团队还首次证实了免疫检查点系列分子在器官移植排斥中的作用,并发现其可以作为新型免疫抑制剂开发的靶点。免疫检查点分子是免疫系统中的抑制性调节分子,广泛表达在免疫细胞上,临床上主要通过单克隆抗体阻断免疫负调控信号进而增强肿瘤免疫效果。团队通过小鼠心脏移植模型和临床肾脏移植样本调查发现,在器官免疫排斥发生时,PD-1、LAG3、CD80等免疫负调控分子在T细胞和其他免疫细胞中的表达量显著升高,团队推测是免疫系统为了建立免疫耐受,以对抗免疫细胞的过度活化。然而,团队检测发现其相应的配体分子比如PD-L1、CTLA-4和FGL1在体内并没有相应的升高表达,因此免疫耐受仍然难以建立。开发免疫检查点分子激动剂(小分子药物或单抗)难度大,到目前为止还没有上市药物。由于细胞膜可以很好的表达复杂结构膜蛋白,为呈递免疫检查点配体分子、增强免疫负调控,重建免疫耐受提供了可能。该团队前期通过基因工程技术,制备了可以高表达配体分子的细胞膜纳米囊泡,并发现其能够在体内外有效地抑制PBMC和T细胞的增值,延长移植器官的存活时间。(ACS Nano. 2020 Jul 28;14(7):7959-7969,副封面文章,IF=15.9;Biomater Sci. 2021 Feb 23;9(4):1246-1255. 封面文章,IF=6.8;Theranostics. 2021 Apr 7;11(12):6033-6043. IF=11.6)。
虽然细胞膜囊泡制备简单和来源充足,已经成为了非常有前景的生物递送材料,但是也还存在很多问题。首先,在制备过程中,膜的不完整性、内外膜翻转,都有可能降低囊泡的治疗效率。此外,针对一些免疫性的疾病,细胞膜囊泡可能由于其免疫原性而给免疫疾病的治疗带来未知的安全隐患,所以课题组一直在寻找更有效、生物相容性更高的生物材料。外泌体是一种细胞分泌的天然脂质双层膜结构,与细胞膜囊泡相比具有更好的临床应用潜力。课题组前期利用IFN-γ诱导了黑色素瘤细胞分泌高表达PD-L1的外泌体,并证明了其良好的免疫抑制能力(此研究结果发表在 Journal of Extracellular Vesicles, 2020,(9):1709262. IF=25.841)。
近日,该研究团队在Advanced Science上发表了题为“Engineered small extracellular vesicles as a FGL1/PD-L1 dual-targeting delivery system for alleviating immune rejection”的研究论文(副封面文章,IF=16.806)。在此研究中,作者鉴定LAG-3和PD-1是两个潜在的器官移植免疫排斥治疗靶点,成功制备了间充质干细胞来源的FGL1/PD-L1双靶点外泌体,发现其能够在小鼠异体心脏移植模型中有效减轻移植排斥,展现了良好的治疗效果。
脐带间充质干细胞已经开展了包括器官损伤修复在内的多种难治性疾病的临床研究,被证明是一种安全有效的细胞。间充质干细胞来源的外泌体(MSC-EVs)具有MSC的大部分特性,并具有细胞免疫调节功能,现已被证明可以通过调控T细胞和B细胞的增殖来调控适应性免疫反应,所以MSC-EVs成为治疗免疫性疾病绝佳的生物载体。课题组采用生物工程技术改造MSC,获得了PD-L1/FGL1双表达的MSC-sEVs。同时体外细胞学和体内动物模型实验结果均发现,PD-L1/FGL1双表达MSC-sEVs具有更强的抗器官移植免疫排斥作用。最后还证明,PD-L1/FGL1双表达MSC-sEVs联合低剂量的FK506,起到显著的协同治疗效果。器官移植排斥最好的治疗手段是重建免疫耐受,而Treg细胞和Th1/Th2的比例在免疫耐受重建过程中至关重要。前期研究表明FK506不能重启Treg细胞,因为Treg细胞是较少依赖于NFAT信号途径的。但研究发现,PD-L1/FGL1双表达MSC-sEVs具有优异的重建Treg细胞和Th1/Th2比例的能力,这或许是两者联合取得更好治疗效果的分子理论基础。
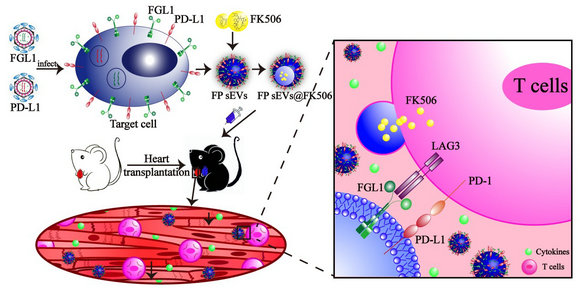
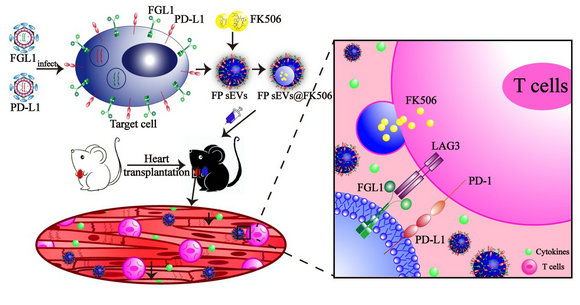
高表达FGL1/PD-L1的间充质干细胞外细胞囊泡抑制心脏移植排斥反应示意图
上述研究得到了国家自然科学面上项目、广东省自然科学基金面上项目、深圳市科创委基础研究重点项目和中山大学重大和交叉项目培育基金等多个项目的支持。
项目组已建立先进的高通量遗传文库筛选技术平台(CRISPR pooled gRNA libraries),致力于自身免疫和移植免疫领域的新机制和新靶点发现,并开发基于新靶点的新型免疫抑制剂药物。同时,团队也成功建立了规模化的人源和植物源外泌体大规模制备和应用平台。
相关论文链接:
1. https://doi.org/10.15252/emmm.202012834
2. https://pubs.acs.org/doi/10.1021/acsnano.9b09065
3. https://doi.org/10.1039/D0BM01798A
4. https://www.thno.org/v11p6033.htm







