很少有疾病能比阿尔茨海默氏症(AD)更能引起人们的恐惧和无奈。在过去的一个多世纪,研究人员已经开展了400多项AD药物临床试验,但迄今为止尚无一个治本(阻止疾病进程)的药物可用。究其原因,很重要的一条是AD动物模型不能模拟人类AD病人的真实情况,从而导致有很多候选药物在动物模型中有效,但在AD病人的临床试验中则无效。在过去的25年,科学家们相继建立了200多个AD动物模型,但由于设计或技术方面的缺陷,迄今未能获得一个真正能够全面反映人类AD病理表型和疾病机制的动物模型,这在很大程度上妨碍了对AD的研究和临床药物开发。建立人源化、能够全面模拟人类AD的动物模型,一直是AD领域机制研究和药物开发亟需解决的一大难题。
近日,由著名神经科学家、清华大学药学院教授鲁白领衔的团队,在该领域实现了重大突破,成功开发了能够全面模拟AD的基因敲入大鼠模型,相关成果日前以长文的形式在线发表在《细胞研究》(CellResearch)期刊上。
大脑中淀粉样蛋白的沉淀(Aβ)被认为是AD病人的主要病理表现和主要病因。而Aβ的前体App基因的一些突变,会大大加速Aβ沉淀。因此,以往绝大多数的AD模型,采用各种各样的转基因技术,将不同突变型的App基因表达在小鼠中。而转基因技术有一系列不可避免的的缺陷:将人类App突变基因随机插入小鼠的染色体中,可能破坏插入处小鼠自身正常基因的表达;导致基因表达在错误的脑区,错误的细胞,或者错误的时间等;最大的缺陷是导致App的过量表达并被酶切成Aβ和一些非生理的蛋白片段,它们会扰乱小鼠的正常生理功能,导致了与AD无关的表型。
在这项研究中,鲁白教授团队刻意避免使用转基因技术,而采用了CRISPR/Cas9基因敲入技术,在大鼠体内实现了人源App基因的替换,同时携带了三个人类家族突变(AppNL-G-F),而不改变App蛋白及其片段在脑内的时间和空间的表达水平。系统的病理学,细胞生物学和行为学研究表明,该模型与现有其他AD动物模型相比,显示出与人类AD患者更相似的病理和疾病进展。
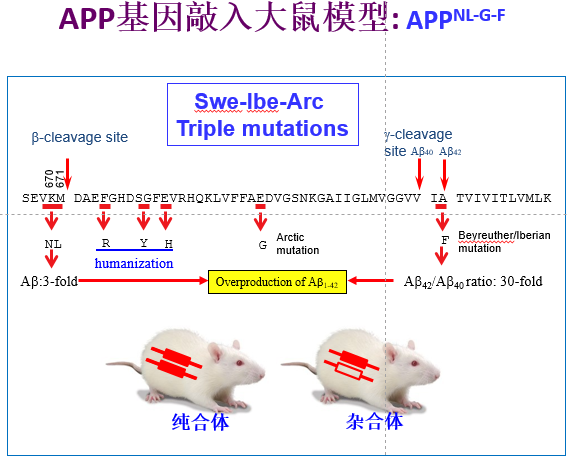
图1:突变引入到App第16和17外显子。突变的位点和突变位点的作用在氨基酸序列中进行了示意。
据该论文的第一作者逄克亮博士介绍,在大鼠中实现人源App基因的替换并同时进行多个家族突变的原位敲入很具挑战。由于上述三个家系突变分布在App基因的两个外显子上,将它们同时准确无误地敲入基因组并实现人源化,其成功率很低。公开文献显示,国际上有诺贝尔奖获得者在内的多个团队曾试图进行类似App突变的敲入,均未成功。而鲁白团队也是在200多个App突变敲入大鼠系中,才筛选到了一个准确的AppNL-G-F敲入大鼠。
研究人员在对该AppNL-G-F大鼠中App蛋白和多个酶切片段进行了详细分析,发现人源App基因的替换,既解决了传统转基因模型常见的Aβ过表达和非生理分布缺陷,又避免了基因随机插入对原位基因表达的破坏性导致的死亡,因此更准确地模拟了AD大脑中病理发生机制。
在AD病人大脑中,有异常高的磷酸化tau蛋白以低聚物纤维形式存在。但在以往几乎所有的App小鼠模型中都缺少tau病理表型。鲁白团队用4种方法证明,该大鼠模型大脑有类似于人类的高磷酸化的tau,以及病理性tau蛋白聚合物。该结果揭示了Aβ病理和tau病理其潜在关系,为Aβ致病假说提供了强有力的证据,也为继续深入研究其中的机制提供了方向。
人类AD大脑的第三个显著变化是神经细胞的死亡和大脑萎缩(表现为脑室扩张)。而以往的AD动物模型都不能模拟大脑萎缩这一关键疾病进展,即使细胞死亡也罕有报道。鲁白团队在AppNL-G-F大鼠中发现了程序性凋亡和程序性坏死两种发生于AD病人中的主要细胞死亡形式,并随着疾病的进展表现出了脑组织重量减轻和脑室的扩张,这也是科学家首次在人类AD以外的动物模型中观察到脑室的扩张。从AD发现至今100多年,但科学家们却一直没有找到AD患者神经元死亡的确切原因,该AppNL-G-F大鼠为研究这一问题提供了工具。
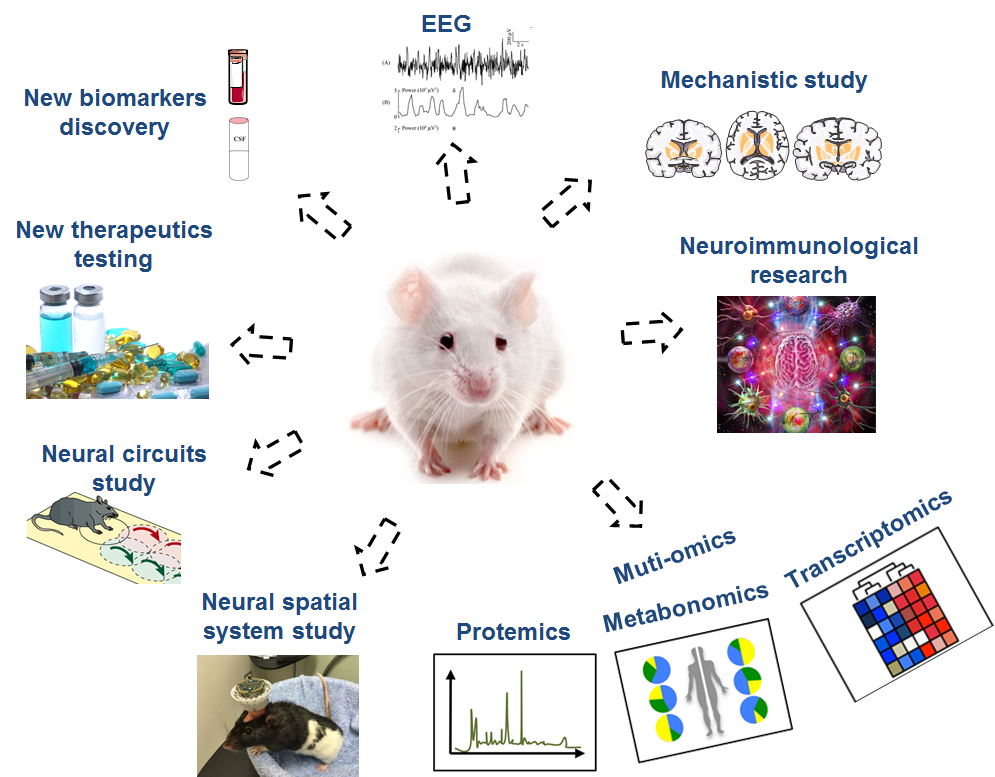
图2.显示大鼠模型为研究AD的不同层次的发病机制,AD早期诊断的敏感生物标记物发现和创新药物的疗效等,提供了不可或缺的工具
用基因敲入的方法建立AD动物模型,并非没有被尝试过。2014年,日本科学家Saido研究组用几乎完全相同的策略,制作了基因敲入型AppNL-G-F小鼠模型。鲁教授团队将其研发的AppNL-G-F大鼠与Saido的AppNL-G-F小鼠做了头对头的比较研究。一个令人惊叹的结果是,与AppNL-G-F大鼠不同,该小鼠模型欠缺AD患者大脑中的最关键的病理表现,即tau蛋白病理、神经细胞的持续性死亡,及其导致的脑萎缩(表现为脑室扩张)。该结果提示AppNL-G-F大鼠是更接近人类AD的动物模型。
此外,研究人员发现在AppNL-G-F大鼠脑中胶质细胞的显著活化。尤为重要的是,小胶质细胞和星形胶质细胞在Aβ斑块周围聚集,这反映了与AD患者大脑类似。其次,发现该大鼠模型大脑有类似人类AD的突触损伤和脑区特征。该AppNL-G-F大鼠动物模型的建立,将成为验证目前公认的基于突触修复的新型治疗策略的有效工具。
最后,研究人员通过多种行为实验范式,发现该模型大鼠全方位地出现了人类AD的多种记忆障碍。尤为重要的是,研究人员用一种精巧的更接近于人类行为的触屏技术,证明AppNL-G-F大鼠具有明显的情景记忆障碍。情景记忆的缺失是AD患者最早也是最为常见的行为表现,但在小鼠模型中应用触屏技术却很难。因此,该研究结果也展示了大鼠AD模型的另一优越性。
这项研究由清华大学药学院鲁白教授和逄克亮博士发起并领导。逄克亮博士为该论文第一作者,鲁白团队副研究员郭炜博士为共同通讯作者,联合瑞典卡洛琳斯卡医学院佩尔·尼尔森(PerNilsson)研究组、中科院心理学研究所王玮文研究组、中科院自动化研究所蒋田仔研究组和韩华研究组等多个科学家团队通力合作,历时数载,才成功地建立了全世界领先的AD模型。






