疼痛治疗是我国乃至全球范围内最大的医疗负担之一。华东师大与华西医院联手研究,发现并确证了慢性疼痛治疗新靶标,这个“从0到1”的研究为研发原创新药提供源头。
华东师范大学生命科学学院阳怀宇课题组携手四川大学华西医院蒋若天研究员团队聚焦于小分子驱动的神经精神疾病新靶标发现和确证研究,发展了基于动态构象的小分子设计方法,用于解决离子通道活性小分子发现这一世界级难题。
从0到1:发现治疗慢性疼痛新靶标
疼痛治疗是我国乃至全球范围内最大的医疗负担之一。在慢性疼痛治疗中,吗啡阿片类药物具有很强的镇痛效果,但仍具有诸如耐受及痛觉超敏的副作用。非甾体类抗炎药也广泛用于慢性炎性疼痛治疗,但镇痛效果不理想。发现和确证新的镇痛靶标,从源头上驱动抗炎镇痛新药研发是慢性炎性痛治疗的巨大需求。
新靶标发现和确证是医药领域从0到1的研究。对化学、药学、生物学和医学等多学科的交叉融合有很高的要求,需要运用新方法和新策略。
华东师大生命科学学院阳怀宇课题组携手四川大学华西医院蒋若天研究员团队,在CellResearch杂志在线发表了题为InhibitingHv1channelinperipheralsensoryneuronsattenuateschronicinflammatorypainandopioidsideeffects的研究论文,首次报道了电压门控质子通道(Hv1)是治疗慢性疼痛的新靶标。
Hv1或具有新的神经生物学功能
Hv1属于电压门控离子通道超家族,也是结构最简单的电压门控离子通道之一。在细胞去极化,胞内质子浓度高于胞外时,Hv1激活可迅速将胞内的质子移送至细胞外。在哺乳动物神经系统中,Hv1是唯一的质子选择性离子通道。在过去10年里,所有针对神经系统Hv1的研究中,大多局限于小胶质细胞。
研究团队发现Hv1在小鼠背根神经节(DRG)神经元中表达,并且在急、慢性炎症刺激或神经元过度兴奋后,Hv1表达出现显著性上调。在人皮肤神经末梢组织中,也发现Hv1的表达。
这一发现提示Hv1或具有新的神经生物学功能。
离子通道类蛋白非常缺乏选择性药理工具。Hv1通道体系小,开发抑制剂还面临额外困难。之前报道了锌离子和胍类衍生物可以抑制Hv1通道,但由于缺乏Hv1特异性药理工具,目前大多数Hv1功能研究中,都依赖基因敲除动物(Hv1敲除鼠)及非选择性抑制剂。
阳怀宇团队曾揭示靶向离子通道中间态可用于发现抑制剂。借鉴该非经典调控策略,在本研究中研究团队设计得到靶向Hv1通道动态中间态的抑制剂YHV98-4。电生理实验显示该化合物对Hv1具有高度选择性。
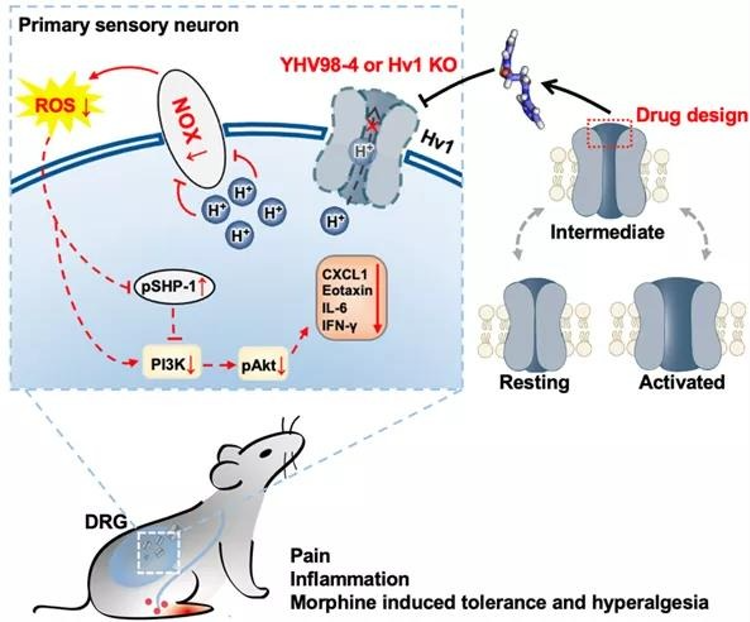
研究人员利用新的抑制剂、Hv1KO小鼠以及AAV病毒介导的背根神经节感觉神经元上Hv1的特异性敲减策略,分离、鉴定和评估了正常与炎症条件下DRG神经元上Hv1介导的质子电流,发现在炎症状态或神经病理性疼痛状态下,Hv1介导的质子电流均显著上调。
意外的是,Hv1在神经元中质子电流特性与其在小胶质细胞中的电流特性在动力学方面有显著差异。接下来,通过质子成像技术揭示了Hv1在DRG神经元质子稳态维持中扮演重要角色:发现抑制Hv1可以缓解慢性疼痛下背根神经节感觉神经元的胞内pH碱化,进而抑制NOX依赖的ROS生成。
抑制Hv1可有效缓解病理性疼痛
为了进一步验证Hv1参与了慢性炎症及疼痛的发展,在动物水平实验中,作者联合药理、Hv1全基因敲除及DRG神经元Hv1特异性敲减的手段,发现抑制Hv1可以有效缓解病理性疼痛,改善炎症状况。同时,作者也揭示了抑制Hv1可以通过修复受损的ROS-SHP-1-PI3K/pAKT-CXCL1通路达到抗炎效果。
由于ROS及CXCL1均参与吗啡引起的耐受及痛觉过敏等不良反应,作者猜想Hv1可能参与吗啡引起的上述不良反应。接下来,作者利用药理抑制及DRG神经元Hv1敲减,发现抑制Hv1的确可以有效缓解吗啡使用带来的副作用及降低ROS产生。
该研究首次报道了Hv1在神经系统中新的细胞类型中的新功能,并开发了首批具有良好选择性且具有invivo应用潜力的Hv1抑制剂,并结合其他手段,揭示了Hv1可能是潜在的慢性疼痛治疗及改善吗啡引起的不良反应的新靶标。
该研究以华东师范大学为第一单位,与四川大学华西医院合作完成。蒋若天研究员和阳怀宇教授为该论文共同通讯作者,华东师大张乾森副研究员、四川大学华西医院任益民、华东师大莫奕青及郭佩佩和四川大学华西医院廖萍及罗运成为共同第一作者。






