嗅觉作为基本感觉之一,对于物种生存和适应环境具有重要作用。嗅觉障碍是多种疾病(如神经精神性疾病和新型冠状病毒性肺炎)的常见临床症状。嗅觉系统由鼻腔嗅粘膜(外周嗅觉系统)、嗅球、嗅觉中枢三部分组成,气味分子被鼻腔嗅粘膜的嗅觉神经元特异性识别后,将信号传递到嗅球-嗅觉信息传导的中转站,嗅球进一步处理嗅觉信息后,再传递给嗅觉中枢—大脑的嗅皮层(图1)。近年来,科学家们对嗅觉调控相关神经环路的研究取得了较大进展,但对嗅觉调控的外周靶点还知之甚少。
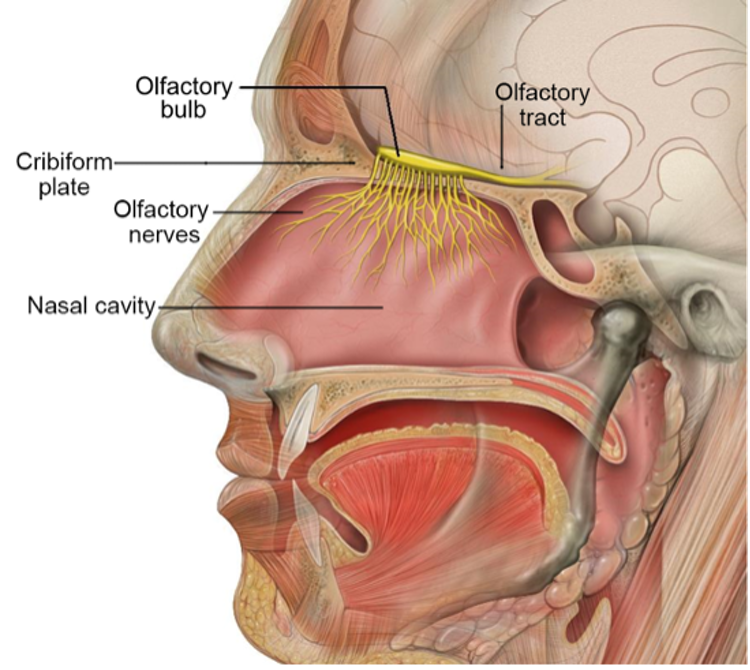
图1:嗅觉传导的神经通路
偶然发现:DRD2受体在鼻腔中大量表达
多巴胺是一种单胺类神经递质,其受体有两种类型:兴奋性D1类受体(DRD1和DRD5)和抑制性D2类受体(DRD2、DRD3和DRD4)。其中,Drd2与精神分裂症等精神疾病密切相关,是临床常用抗精神病药物的作用靶点。殷东敏课题组前期构建了Drd2基因报告荧光小鼠,发现Drd2在鼻腔中的成熟嗅觉神经元中高表达。DRD2分布在嗅觉神经元的胞体和纤毛,并且和其它嗅觉受体共存与同一个细胞(图2)。值得注意的是,单细胞基因表达数据表明,人和鼠的成熟嗅觉神经元只表达Drd2,而并不表达其它类型的多巴胺受体。
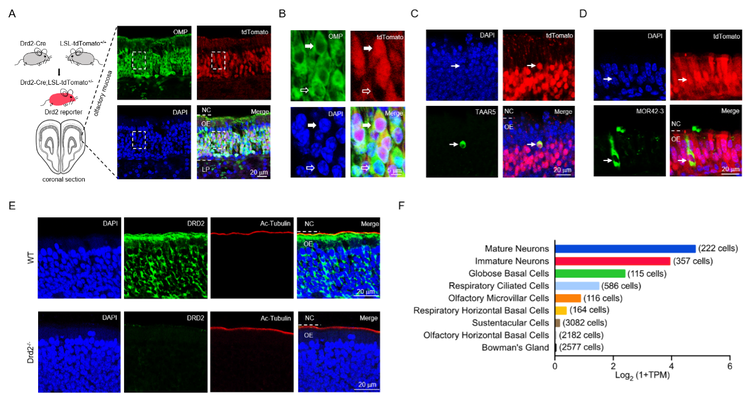
图2:DRD2分布在小鼠鼻腔成熟嗅觉神经元的胞体和纤毛
(A-B)Drd2荧光基因报告显示Drd2在大部分成熟嗅觉神经元中表达。B是A图中画框部分的局部放大。(C)Drd2与嗅觉受体TAAR5表达在同一个嗅觉神经元中。(D)Drd2与嗅觉受体MOR42-3表达在同一个嗅觉神经元中。(E)DRD2蛋白分布在小鼠嗅觉神经元的胞体和纤毛。下面是Drd2基因敲除小鼠的阴性对照。(F)人嗅粘膜主要细胞类型的Drd2表达水平。
功能论证:鼻腔中的多巴胺通过DRD2对嗅觉功能产生紧张性抑制
鼻腔中的多巴胺主要由支配嗅粘膜的交感神经末梢释放。DRD2是一种抑制性G蛋白偶联受体(降低环磷酸腺苷cAMP的产生),而大部分嗅觉受体属于兴奋性G蛋白偶联受体(增加环磷酸腺苷cAMP的产生)。由于DRD2和嗅觉受体都分布在嗅觉神经元的纤毛上,我们推测多巴胺通过DRD2会抑制气味分子-嗅觉受体的cAMP信号通路(图3)。研究者们首先在转染DRD2和嗅觉受体的Hana3A细胞上检验这一假说。多巴胺可以剂量依赖性地抑制气味分子对嗅觉受体cAMP信号通路的激活。通过对嗅觉神经元放电记录的方法,研究者们发现,在急性分离的嗅粘膜组织上给予DRD2激动剂可以剂量依赖性的抑制气味分子对嗅觉神经元的电信号激活。在整体行为水平上的研究发现,鼻腔给予多巴胺或DRD2激动剂可以抑制小鼠对气味分子的嗅觉敏感性。相反,抑制鼻腔中的DRD2或敲除嗅觉神经元中的Drd2可以增强小鼠的嗅觉敏感性。以上结果证明,鼻腔中的多巴胺通过DRD2对正常小鼠的嗅觉功能产生紧张性抑制作用。
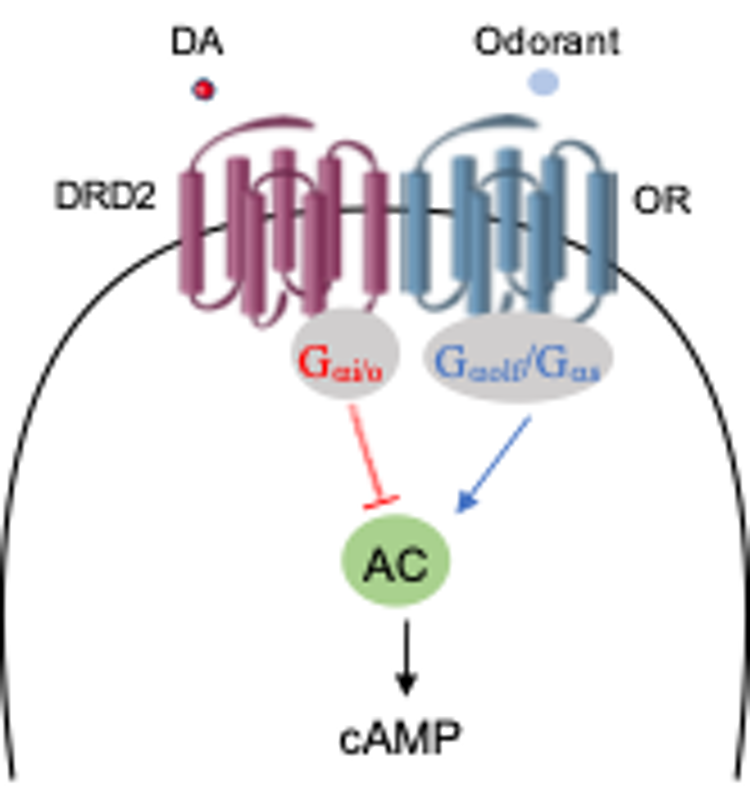
图3:多巴胺通过DRD2抑制气味分子-嗅觉受体的cAMP信号通路
生理意义:饥饿时小鼠鼻腔中多巴胺合成减少,引起嗅觉功能增强
为什么人们在饥饿时会觉得饭菜更香?这是因为一定时间的禁食会增强嗅觉功能。人和动物在饥饿时嗅觉增强有助于觅食,这对进化过程中物种的生存尤为重要。我们的研究结果发现,饥饿时,小鼠鼻腔中多巴胺合成减少,对嗅觉功能产生去抑制,引起嗅觉敏感性增加。更有意思的发现是,鼻腔给予正常小鼠6-羟基-多巴胺,损毁支配鼻粘膜的交感神经末梢,降低鼻腔内多巴胺的来源,可以使正常小鼠的嗅觉能力提高到饥饿小鼠的水平。这些结果证明,饥饿时小鼠鼻腔中多巴胺合成减少可能是饥饿导致嗅觉能力增强的重要机制之一(图4)。
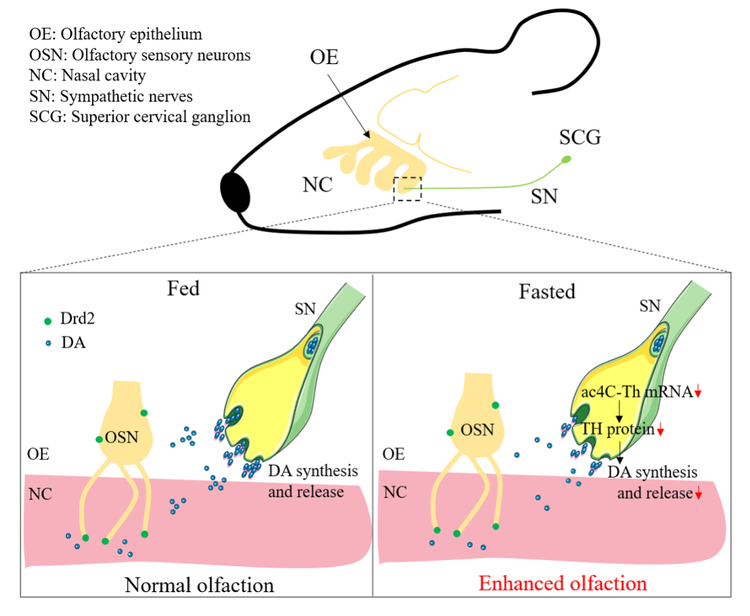
图4:鼻腔中DRD2调节嗅觉敏感性
应用前景:抑制鼻腔DRD2可能有助于治疗精神分裂症病人的嗅觉障碍
精神分裂症病人经常伴随着多巴胺的过度释放和嗅觉障碍。抑制中枢神经系统的DRD2可能产生焦虑、抑郁或肥胖等副作用。我们的结果提示,靶向抑制鼻腔DRD2可能有助于治疗精神分裂症病人的嗅觉障碍。课题组目前已经递交了相关发明专利,并通过国家知识产权局初步审查。
这些结果阐明了鼻腔中的多巴胺D2受体可作为嗅觉调控的外周靶点。上述工作以OlfactoryregulationbydopamineandDRD2receptorinthenose为题发表在《美国科学院院报》(PNAS)。华东师范大学为该论文第一完成单位,上海交通大学和浙江大学为该论文的共同完成单位。华东师范大学博士生周海倩、浙江大学王平教授课题组博士后庄柳静、上海交通大学博士生包红强为论文的共同第一作者,华东师范大学生命科学学院脑功能基因组学教育部重点实验室殷东敏研究员为最后通讯作者,上海交通大学医学院李乾研究员为共同通讯作者。殷东敏课题组长期从事精神分裂症发生机制和治疗靶点的转化医学研究。该工作得到了国家自然科学基金委、科技部精准医疗重点研发计划、国家脑计划、上海市脑科学中心、神经科学国家重点实验室开放课题等项目的资助。

《美国科学院院报》刊登殷东敏研究团队发现
本文第一作者周海倩是华东师范大学生命科学学院博士二年级学生,她在2021年11月举行的长三角神经科学青年论坛上汇报了这一研究成果,并获得长三角研究生二等奖。论坛共评出一等奖1名(由中科院神经科学研究所博士生获得),二等奖2名,三等奖3名。近年来,华东师大神经生物学研究生毕业后已有多人获得上海市超级博士后、上海脑中心求索博士后、上海市优秀毕业生等荣誉称号。这次周海倩同学获奖再次印证华东师大在神经生物学研究生培养方面取得了很大进步。






